Kobalto jonų radimas
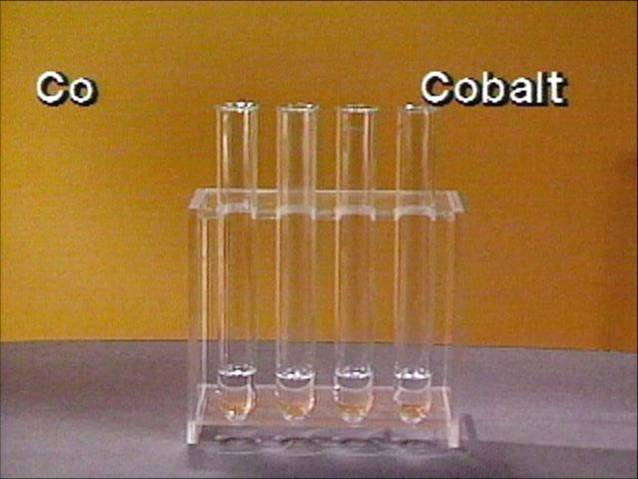
Reakcija su amonio tetratiociano merkuroatu. Ant objektinio stiklelio užlašinamas Co2+druskos tirpalo lašas, greta jo lašas (NH4) [Hg(CNS)4] tirpalo. Lašai sumaišomi ir po kurio laiko susidaro mėlyni kristalai, kurie stebimi mikroskopu. (žr.priedą):
CoSO4 + (NH4) [Hg(CNS)4 ] Co [Hg (CNS)4 ] + (NH4)2SO4
Reakcija su kalio (arba amonio) tiocianatu. Kalio (arba amonio) tiocianatai su Co2+ druskų tirpalais sudaro mėlyną kompleksą:
CoCl2 + 4 NH4CNS (NH4)2[ Co(CNS)4] + 2 NH4 Cl
Reakcija atliekama mėgintuvėlyje. Įlašinami 3 – 5 lašai Co2+ druskos tirpalo, pridedama keli lašai kalio (arba amonio) tiocianato tirpalo. Matoma mėlyna susidariusio junginio spalva. Ji tampa intensyvesnė, kai į reakcijos mišinį įlašinami keli lašai acetono ar etanolio.
http://lt.wikipedia.org/wiki/Kobaltas
Kobaltas – cheminis periodinės elementų lentelės elementas, žymimas Co, eilės numeris 27.
Savybės[taisyti | redaguoti kodą]
Zr. Toliau prie paaiskinimo kas yra feromagnetikas. Kobaltas yra stiprus feromagnetikas, jo spalva – sidabriškai balta.
Paplitimas[taisyti | redaguoti kodą]
Kobaltas Žemėje nerandamas kaip grynuolis, tik rūdoje, tačiau išgaunamas kartu su kitais metalais – dažniausiai nikeliu ar variu. Pagrindinės kobalto rūdos yra kobaltitas, eritritas, glaukodotas ir skuteriditas. Su paveiksleliais is neto…..;)
Pavadinimo kilmė[taisyti | redaguoti kodą]
Kobalto pavadinimo kilmė – mitologiška. Koboldai germanų padavimuose ir pasakose buvo kalnų, miškų ir namų dvasios; jie galėję suvalgyti sidabrą ir vietoje jo išskirti bevertes sidabro spalvos rūdas. Vokiečių kalnakasiai, dirbę Erzgebirge kasyklose, ilgą laiką niekaip negalėjo išgauti metalo iš kobalto rūdų, kurias laikė vario, sidarbo arba alavo rūdomis ir manė, kad būsią apgauti mitinių koboldų. 1735 m. švedas Georg Brandt atrado šį elementą ir suteikė jam tokį pavadinimą.
| Cheminės savybės | |
| Kovalentinis spindulys | 116 pm |
| Jono spindulys | ? pm |
| Elektroneigiamumas | 1,88 (pagal Polingą) |
| Elektrodo potencialas | ? |
| Oksidacijos laipsniai | 4, 3, 2, 1(amfoterinis oksidas) |
| Atomo savybės | |
| Atominė masė (Molinė masė) | 58,933200(9) а.m.v.(g/mol) |
| Atomo spindulys | 125 pm |
| Jonizacijos energija (pirmas elektronas) | 760,4 kJ/mol (eV) |
| Elektronų konfigūracija | [Ar] 3d7 4s² |

Naudojamas vitamino B-12, skustuvo ašmenų, mėlyno kobalto stiklo (CoO•Al2O3) gamyboje.
Sąveika su oro deguonimi:
Kaitinamas kobaltas reaguoja su vandeniu (taip pat tokiu būdu reaguoja ir su galogenais, azotu, siera, daugeliu nemetalų):
Co (k) + 4O2 (d) → 2 Co3O4 (k)
2Co (k) + O2 (d) → 2CoO (k) (900°C)


Sąveika su rūgštimis:
Kobaltas aktyviai reaguoja su rūgštimis:
Co (k) + 2HCl (aq) → CoCl2(aq) + H2 (d)
3Co (k) +8HNO3(prask.) → 3Co(NO3)2 (aq) + 2NO(d) +4H2O(s)
Co(k) + 4HNO3(konc.) → Co(NO3)2(aq) + 2NO2(d) +2H2O(s)


Su H2 stechiometrinių junginių (molekuliniai pastovios sudėties cheminiai junginiai) nesudaro, bet jį absorbuoja: tuo paaiškinamas Co katalizinis aktyvumas hidrinimo reakcijose.
Šarmuose tirpsta tik esant oksidatorių.
Iš knygos:
Apskritai ri paplitimas/gavimas:
VIIIB grupę sudaro devyni elementai, vienas jų – kobaltas. Jis su geležimi ir nikeliu turi panašių fizikinių ir cheminių savybių – jie visi sudaro geležies šeimą. Įdomu tai, kad ekonomiškai naudingi Co telkiniai buvo randami kartu su vario sulfidu (rūdimis), o senieji germanų kalnakasiai jas vadindavo “kobold” – kalnų piktąja dvasia, nes jiems trukdydavo išgauti varį.
Savybės:
Kobaltas – kietas, blzgus, pilkas metalas; kaip ir geležis (Fe) – feromagnetinis. Kas tai? Iš esmės visi atomai yra mažyčiai magnetai, tačiau didžiojoje dalyje medžiagų šie magnetai yra išdėstyti atsitiktine kryptimi, tad jų magnetiniai laukai vienas kitą neutralizuoja. Tačiau keletas grynųjų metalų yra feromagnetikai. (žr. paveiksl.)

Kobaltas su kitu geležies šeimos nariu nikeliu daugiausia vartojami lydiniams: termiškai atspariems (nichromui, iš kurio gaminamos elektrinių plytelių ir krosnių kaitinimo spiralės) ir monetiniams (melchiorui, iš kurio gaminamos monetos ir papuošalai). Smulkiadispersiai Co ir Ni – aktyvūs organinių junginių reakcijų, pavyzdžiui, augalinių aliejų hidrinimo, katalizatoriai. Co junginiai nudažo stiklą tamsiai mėlyna spalva.
Junginiai.
Geležies šeimos metalai sudaro nulinio oksidacijos laipsnio junginius pagal koordinacinį mechanizmą, vienas jų – kobalto dibranduolinis kompleksas oktakarbonilas Co2(CO)8.
Rusvos spalvos silpnų amorfinių savybių Co(OH)2 tik stiprūs oksidatoriai, tokie kaip Cl2, Br2, H2O2 oksiduoja į juodai rudą Co(III) hidroksidą:
Co(OH)2 + Cl2 + 2H2O Co(OH)3 +2HCl
Co hidroksidas(III) gaunamas oksiduojant jo druskas ir hidroksidus:
2Co(OH)2 + NaClO + H2O 2Co(OH)3 + NaCl
o neutralizuojamas hidroksidas skyla, todėl Co druskų (III) nepavyksta gauti:
4Co(OH)3 + 4H2SO4 4CoSO4 + O2 + 10H2O
Kaitinant Co(OH)3 palaipsniui dehidratuojasi.
Co2+ jonai nepaprastai giminingi tokiems azoto N donorams kaip NH3, EDTA, NCS- ir kitiems, todėl jo kompleksinių amoniakatų ir aminokompleksų labai daug. Co(III) kompleksai lengvai gaunami oksiduojant Co2+ tirpalus, kai esama atitinkamų ligandų (kompleksinio chem. junginio dalis), pavyzdžiui, NH3:
4 Co2+ + 4 NH4+ + 20 NH3 + O2 2 H2O + 4 [Co(NH3)6]3+
Kobalto kompleksai plačiai naudojami analizinėje chemijoje, taip pat kaip katalizatoriai ne tik alkilų grupės grandinėms oksiduoti į aromatinius angliavandenilius, bet ir alkanų oksidacijai.
Paimta is paplitimo virsuj:
Kobaltitas – sulfidų klasės mineralas, kobalto sulfidas, CoAsS.
Tankis – 6,33. Kietumas pagal Moso skalę – 5,5.
Būdamas retas, šis mineralas yra strateginio metalo, kobalto, rūda. Mineralas susidaro aukštatemperatūrinėse hidroterminėse gyslose.
Kobaltito spalva rudai sidabrinė, pilka su violetiniu atspalviu ar juoda. Pakaitintas pasižymi magnetinėm savybėm, nepermatomas, metalinio blizgesio.
Randamas Kanadoje, Švedijoje, Norvegijoje, Indijoje ir Azerbaidžane.
Eritritas – org. junginys, tetrahidroksilinis alkoholis, bespalviai kristalai. Jis randamas kai kuriose samanose, kerpėse, dumbliuose; ištirpęs vandenyje sudaro tirštą, saldų tirpalą.
