Maisto baltymai:
Visaverčiai tie baltymai, kurie turi visas nepakeičiamas, organizme nesintetinamas a.r. (Val, Leu, Ile, Phe, Trp, Met, Tre, Lys). Vaikams taip pat Arg ir His papildomai
Nevisaverčiais laikomi tokie baltymai, kurie neturi bent vienos nepakeičiamos a.r. Pvz. kukurūzų baltymai (neturi Trp). Visaverčiai yra daugiau gyvulinės kilmės baltymai (kiaušinio, pieno baltymai).
Baltymų virškinimas (trumpai aminorūgščių rezorbcija):

Baltymų puvimo produktų nukenksminimas žarnyne:
Puvimo metu a.r. storojoje žarnoje yra dekarbokslinamos ir deamininamos. Taip veikiant mikrofloros dekarboksilazėms iš a.r. susidaro aminai. Kai kurie iš jų yra toksiški. Taip susidaro:
iš histidino – histaminas;
iš tirozino – tiraminas;
iš fenilalanino – feniletilaminas;
iš ornitino – putrescinas;
iš lizino – kadaverinas.
Putrescinas ir kadaverinas yra toksiški aminai. Tai vadinamieji ptoaminai – medžiagos, kurios paprastai susidaro pūvant lavonams. Jie vadinami lavonų nuodais. Jeigu jų būtų daug rezorbuojama, jie sukeltų traukulius, aritmijas, mažina kraujospūdį.
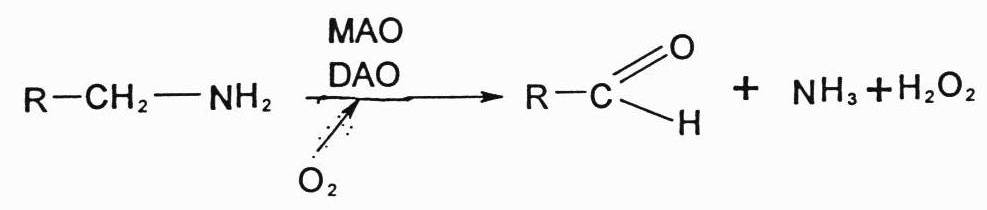
Toksiški aminai storajame žarnyne yra nukenksminami oksiduojant juos žarnyno gleivinėje esanšiems fermentams monoaminooksidazėms (MAO) ir diaminoksidazėms (DAO). Jie yra oksiduojami ir deamininami. Iš amino susidaro aldehidas, amoniakas ir vandenilio peroksidas.
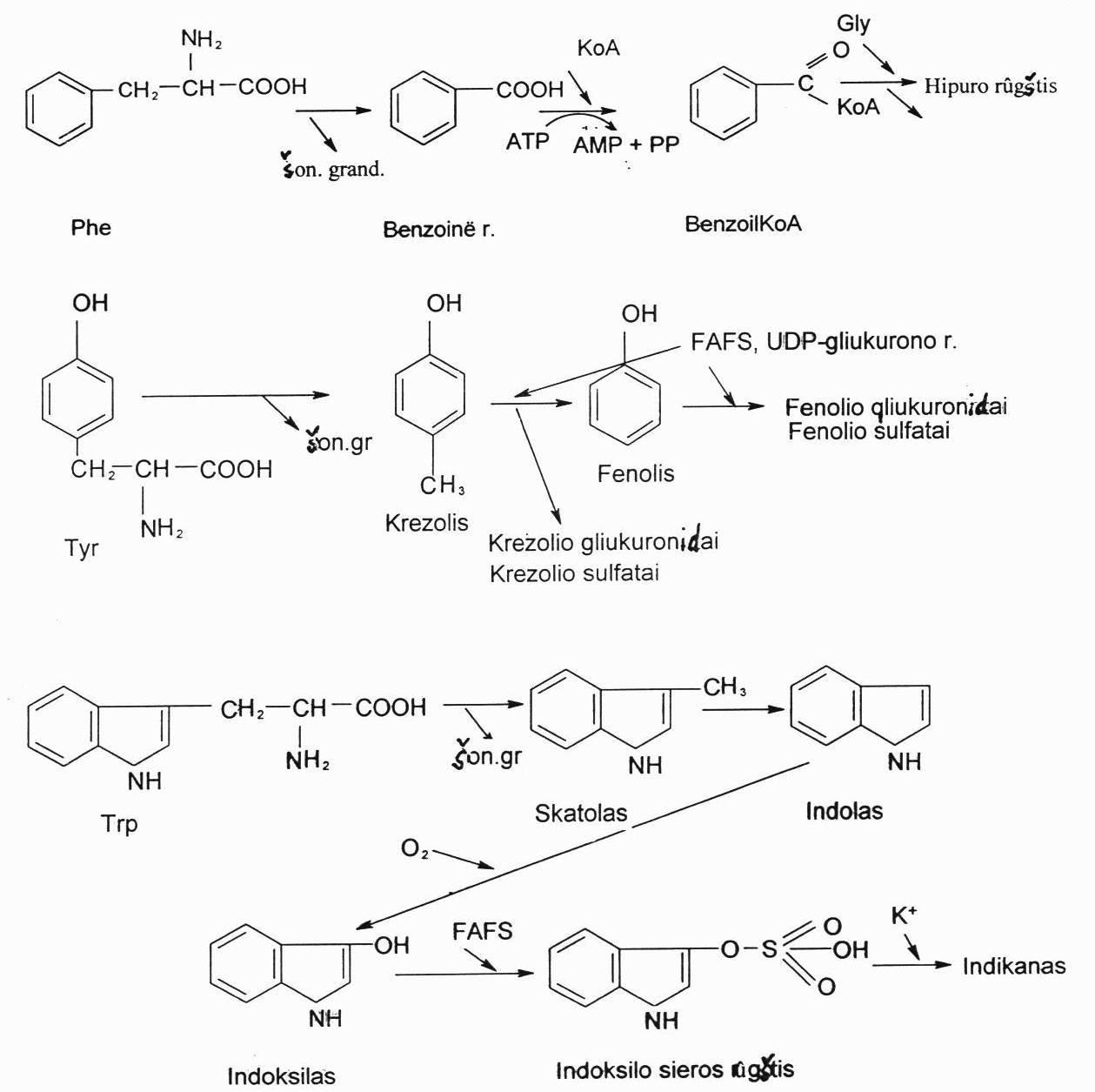
Aromatinės a.r. gali būti nukenksminamos ir kitaip. Veikiant mikroorganizmams iš aromatinių a.r. žarnyne atskėlus jų šonines grandines gali susidaryti ir kitokie nuodingi junginiai:
iš Phe – benzoinė rūgštis;
iš tirozino – krezolis ir fenolis;
iš triptofano – skatolas ir indolas. Dalis susidariusio skatolo ir indolo yra iškiriama su išmatomis ir suteikia joms kvapą.
Kepenyse:
Aminorūgščių transaminimas:
A.r. transamininimas vyksta transaminazėms (aminotransferazėms) pernešant α-NH2 grupę nuo a.r. ant α-okso r. Transamininimo r-jos yra grįžtamos. Amino grupės yra pernešamos nuo visų a.r., išskyrus Lys, Arg, ir Tre. Visos kitos a.r. pradinėse skaidymo stadijose yra transamininamos. Amino grupes paima dažniausiai trys α-okso r. – α-okso glutaratas, oksalo acetatas ir piruvatas.

Visų transaminazių kofermentas (prostetinė grupė) yra piridoksalio fosfatas (vit. B6 kofermentinė forma), kuris prijungia amino grupę Šifo bazės ryšiu ir perduoda ją α-okso r. Transamininimas vyksta dviem etapais:
piridoksalio fosfatas prisijungia prie a.r. α-NH2 grupės. Susidaro tarpinis junginys (Šifo bazė), kuriam suskilus, atsipalaiduoja piridoksamino fosfatas ir α-oksorūgštis, susidariusi iš a.r.
piridoksamino fosfatas atiduoda NH2 grupę vienai iš trijų minėtų α-oksorūgščių ir susidaro naujos a.r. – Glu, Asp ir Ala.
R-jų tikslas – įjungti vienų a.r. azotą į okso r. ir sudaryti kitas a.r.
Transaminazių nustatymo diagnostinė vertė:
ASAT nustatymo diagnostinė svarba
ASAT randama:
daugiausia – širdyje ir kepenyse;
mažiau – skeleto raumenyse, smegenyse, inkstuose, kasoje;
nedaug – plaučiuose bei eritrocituose.
Susirgus miokardo infarktu ASAT iš širdies į kraują patenka po 4-6 val, didžiausią aktyvumą pasiekia po 24-36 val, po to pradeda mažėti ir 3-7 parą normalizuojasi. Stenokardijos (krūtinės anginos) priepuolių metu ASAT aktyvumas nepakinta. Todėl ASAT aktyvumo nustatymas kraujo serume svarbus ir šių ligų diferencinei diagnostikai.
Be to, žinomi du ASAT izofermentai: vienas izofermentas randamas kepenų ir širdies ląstelių mitochondrijose, kitas – citoplazmoje. Sveiko žmogaus kraujyje yra nedaug citoplazmos izofermento, o gilaus ląstelių pažeidimo atvejais jame randami dideli kiekiai abiejų izofermentų. Todėl sunkiais hepatitų atvejais ASAT aktyvumas gali būti didesnis už ALAT.
ALAT nustatymo diagnostinė svarba
ALAT randama:
daugiausia – kepenyse;
mažiau – skeleto ir širdies raumenyse, inkstuose;
visai nedaug – kasoje, blužnyje, eritrocituose.
Susirgus kepenų ligomis, ALAT aktyvumas kraujo serume padidėja anksčiau ir daugiau už ASAT – apie 20 kartų sergant ūminiu virusiniu ir toksiniu hepatitais bei paūmėjus chroniniam hepatitui ir tik 3-4 kartus, sergant hemolizine, mechanine geltomis ir kepenų ciroze.
Ligų diferencinei diagnostikai svarbus fermentų ASAT ir ALAT santykis, vadinamas De Ritis‘o koeficientu. Normoje jis lygus 1,33±0,42. Sergant širdies ligomis koeficientas didėja, o kepenų ligomis – mažėja.
Amoniako šaltiniai:
deamininant a.r.;
deamininant biogeninius aminus tiesioginiu oksidaciniu būdu (tuo pačiu jie ir nukenksminami), veikiant MAO ir DAO);
nukleotidų skilimo metu iš visų amino grupes turinčių bazių ir nukleozidų, pirimidininių nukleotidų;
iš heksozaminų ir kitų azotą turinčių junginių, kurių nėra daug;
fermentas ureazė skaido šlapalą į amoniaką ir CO2. Labai dažnai tokia r-ja vyksta organizme, šlapimtakiuose, užkrėstuose ureazę gaminančių bakterijų. Susidaręs amoniakas tada šarmina šlapimą, sukelia nesotaus magnio amonio fosfatas nusėdimą, dėl to gali susidaryti gana dideli inkstų akmenys. Vienas iš požymių, kad yra tokia bakterinė ureazė šlapimtakiuose – aštrus, nemalonus išvietės kvapas.
Aminorūgščių deamininimas:
A.r. deamininimas yra amino grupės pašalinimo būdas. Deamininimo metu nuo a.r. atskyla amino grupė ir a.r. netenka savo specifiškumo. Yra skiriami tiesioginio ir netiesioginio deamininimo būdai (dar skirstoma į oksidacinį ir neoksidacinį).
Labiausiai paplitęs ir svarbiausias – netiesioginis deamininimas, kartais dar vadinamas transdeamininimu.
Netiesioginis (oksidacinis) deamininimas vyksta dviem stadijom:
a.r. transamininimas su α-okso glutaratu. Visada susidaro okso r. ir Glu;
![]()
Glu oksidacinis deamininimas. Katalizuojant L-glutamatDG, kurios kofermentas NAD+, susidaro tarpinis rūgštis imino r. Ji vandens pagalba suskaidoma į amonio joną ir α-oksoglutaratą.
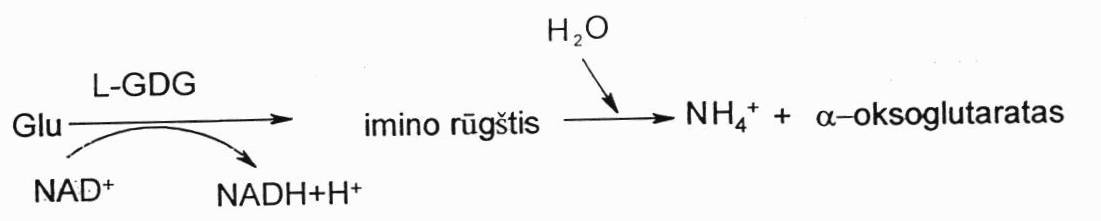
Tiesioginis deamininimas:
oksidacinis deamininimas
Kai yra pakankamai Glu iš karto vyksta Glu oksidacinio deamininimo reakcija, katalizuojant glutamatDG – jau ne kaip antra deamininimo stadija, o iš karto veikiant

Oksiduojant L-a.r.-oksidazei ir D-a.r.-oksidazei, per tarpinį metabolitą susidaro okso r., NH3 ir H2O2. Reakcija vyksta 2 stadijom, tiesiogiai dalyvauja deguonis. A.r. oksidazių (L ir D) randama žinduolių kepenų ir inkstų peroksisomose bei žarnyne, jų aktyvumas nėra didelis, kiek aktyvesnės yra D-a.r.-oksidazės. Prielaida, kad žarnyne mikrofloros pagalba dalis L-a.r. izomerizuojama i D-a.r. Tada jas gali veikti D-a.r.-oksidazė. Šie fermentai veikia paprastai kartu su katalaze, nes susidaro H2O2.
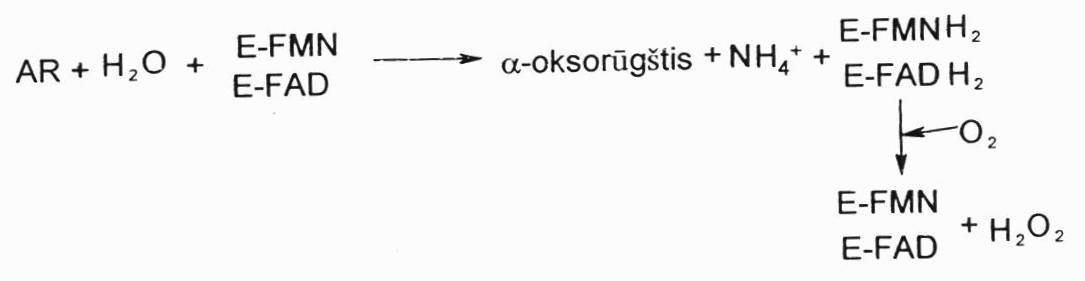
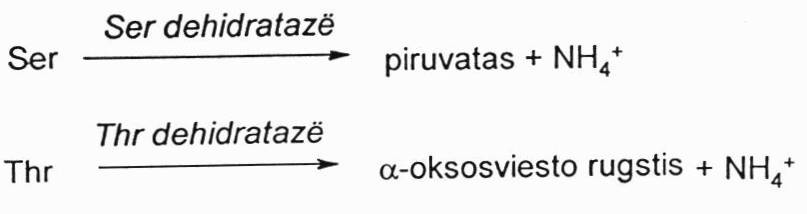
neoksidacinis deamininimas
Jis nėra toks svarbus, nes tokiu būdu deamininimas tik pavienės a.r.
Tokiu būdu deamininami Ser ir Tre, veikiant dehidratazėms. Iš Ser susidaro piruvatas, iš Tre – α-okso sviesto r.
Gali būti vidumolekulinis deamininimas – tokiu būdu deamininmas histidinas, veikiant histidazei ir susidarant nesočiai RR urokanatui. Histidazė yra randama tik odoje ir kepenyse. Urokanatas yra normali prakaito sudedamoji dalis.

Dar vienas būdas yra hidrolizinis deamininimas. Tokiu būdu ląstelėje gali būti deamininimas aromatinės a.r. ir susidaro hidroksi r.
Redukcinis deamininimas yra būdingas anaerobiniams mikroorganizmams (žmogui nebūdingas).
Visais šiais atvejais išsiskiria amoniakas.
GDG:
Tai fermentas, randamas audinių ląstelių mitochondrijose, ypač daug kepenų, inkstų mitochondrijose. Šį fermentą alosteriškai aktyvina ADP ir GDP, o slopina ATP ir GTP. Tai vienintelė gyvūnų organizme aktyvi L-eilės a.r. DG ir jos substratas yra tiktai L-Glu. Per šį netiesioginį deamininimą amino grupės, surinktos iš įvairių a.r. išsisikiria amoniako pavidalu. Tai labiausiai paplitęs deamininimo būdas audiniuose.
Amoniako panaudojimas ir nukenksminimas:
Panaudojimas:
Redukcinio amidinimo r-joje amoniakas panaduojamas Glu sintezei. GlutamatDG katalizuoja priešingą r-ją oksidaciniam deaminiminimui, tik ji naudoja ne NADH, o NADPH. Susidaro Glu ir išsiskiria vanduo (iš kitos pusės jeigu amoniako konc. yra labai didelė, jis išeikvoja labai daug α-okso glutarato ir per šią r-ją stabdomas Krebso ciklas).

Amoniako nukenksminimas smegenyse:
Smegenų ląstelėse amoniakas redukcinio amidinimo būdu jungiasi su α-okso glutaratu ir susidaro Glu. Kitas būdas Glu susidaryti smegenyse – transaminininat šakotų grandinių a.r. (pvz., Val su α-okso glutaratu), nes jų smegenyse yra daug. Tokiu būdu smegenyse susidaro Glu, kurioje yra sujungta viena amoniako molekulė. Glu negali išeiti iš smegenų ląstelių, nes turi neigiamą krūvį. Tada smegenų fermentas glutaminsintetazė prijungia prie Glu antrą amoniako molekulę ir susidaro Gln, kuris jau neturi krūvio ir lengvai išeina iš smegenų ląstelių, patenka į kraują ir su juo gali būti nešamas į kepenis arba į inkstus. Jis taip pat gali patekti į neuronus, kur veikiant neuronų glutaminazei vėl yra atskeliamas amoniakas. Iš Gln vėl susidaro Glu, kuri toliau gali būti dekarboksilinima ir verčiama γ-amino sviesto rūgšimi ir dalyvauti Krebso cikle. Tai kartu yra ir apeinamasis Krebso ciklo kelias smegenyse. Sudirginus neuronus, jie atlieka savo funkciją ir yra verčiami į sukcinatą.
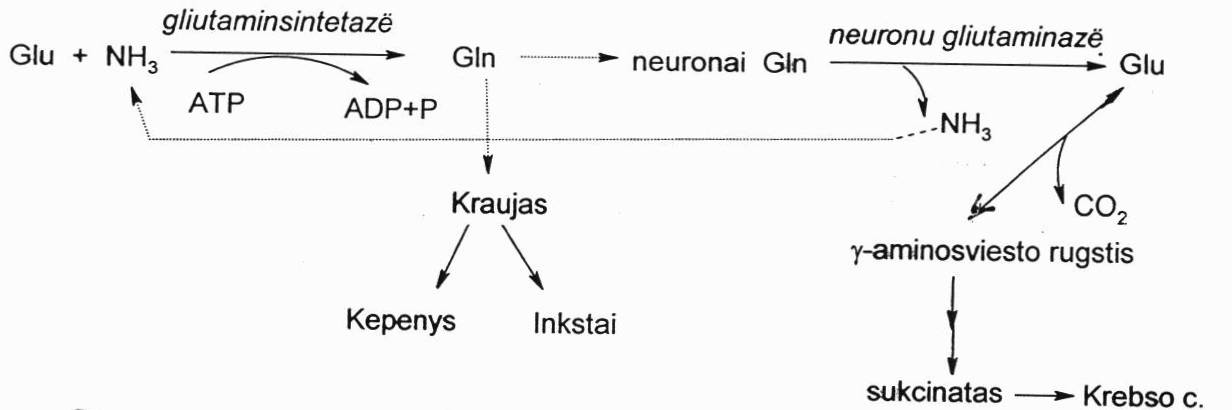
Amoniako nukenksminimas inkstuose:
Iš smegenų arba kepenų patekęs Gln inkstų glutaminazės yra hidrolizuojamas į Glu ir amoniaką. Tada šlapime amoniakas prisijungia vandenilio jonus ir susidaro amonio jonas, kuris lėtai skverbiasi pro membranas.
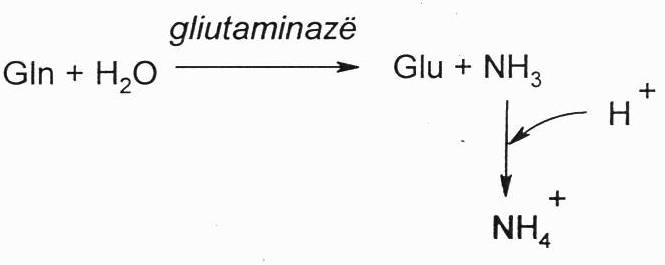
Vandenilio jonų konc. šlapime lyginant su jų konc., kraujyje yra maždaug 800 kartų didesnė. Tai rodo, kad inkstai pajėgia šalinti rūgštinius jonus iš organizmo. Kai amoniakas prijungia vandenilio jonus ir virsta amonio jonu, jis jungiasi su anijonais, dažniausiai su Cl- ir yra šalinamas amonio druskų pavidalu. Šalinama amonio druskų maždagu 1 g/parą. Tokiu būdu inkstai yra apsaugomi nuo acidozės, tiap pat išsaugjomi Na+ ir K+ jonai, nes surišami tik rūgštiniai H+ jonai. Inkstų kanalėliuose amoniako pagalba surišama maždaug 1/2-2/3 dienos rūgštinio krūvio. Kai amonio druskų padaugėja šlapime, tai pasireiškia vadinamoji hiperamoniurija. Jų padaugėja šlapime paprastai esant acidozei. Tada amonio druskų yra šlainama 10x daugiau, nes amonio druskų ekskrecijos sistema, acidozės atveju, yra labai greitai aktyvuojama. Paprastai, kai yra acidozė, šalinami ne tik vandenilio jonai, bet ir daug fosfato jonų, taip pat acetoacetato. Tam, kad būtų išlaikytas elektrinis neutralitetas, atitinkamai reikia šalinti ir katijonus – acidozės pradžijoe yra šalinami Na+ jonai, o kai jie išeikvojami, didėja ir K+ jonų ekskrecija. Būtent dėl amonio jonų, jie labai gerai tvarkosi su acidoze, jei jų nebūtų, vidutinio lygio acidozė galėtų būti mirtina.
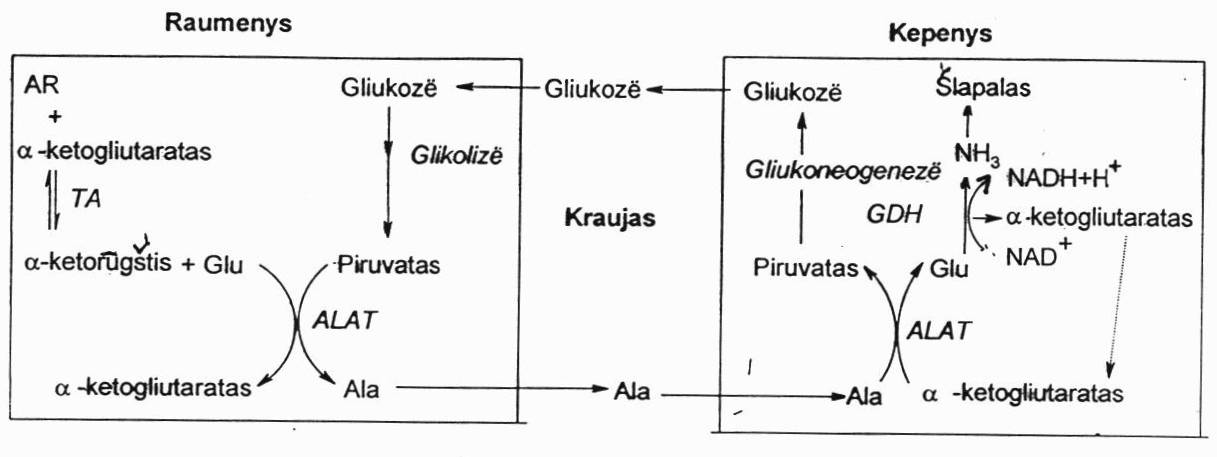
Amoniako nukenksminimas raumenyse:
Raumenyse laisvo amoniako nebūna. Iš raumenų a.r. azotas yra išnešamas įjungtas į Ala. Ala raumenyse susidaro transamininant Glu su piruvatu, katalizuojant ALAT. Glu gaunama transamininant bet kokią a.r. su α-ketoglutaratu. Ala krauju nunešams į kepenis, katalizuojant ALAT yra transamininams. Susidaręs piruvatas panaudojamas gliukoneogenezėje, susidaro gliukozė. Iš Glu per oksidacinį deamininimą išsiskiria amoniakas, kuris yra panaudojamas šlapalo sintezei kepenyse. Šitas kelias yra vadinamas gliukozės-alanino ciklu.
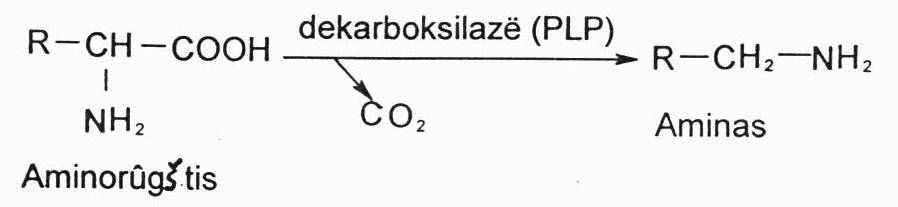
Aminorūgščių dekarboksilinimas:
A.r. dekarboksilinimą katalizuoja specifiškos dekarboksilazės, kurių kofermentas yra piridoksalio fosfatas (vit. B6 kofermentinė forma). Iš a.r. susidaro aminai. Procesas organizme svarbus tuo, kad jo metu susidaro būtent biologiškai aktyvūs aminai – biogeniniai aminai. Kai kurie biogeniniai aminai yra vietiniai hormonai, kiti yra neuromediatoriai.

Tokiu būdu iš histidino (His) susidaro histaminas. Histaminas susidaro jungiamojo audinio putliosiose ląstelėse ir bazofiluose, iš kur yra išskiriamas į kraujo plazmą ir organizmo skysčius. Histaminas veikia kaip vietinis skausmo ir alerginių r-jų mediatorius. Uždegimo židinyje susidarę didesni jo kiekiai:
išplečia smulkesnes kraujagysles (kapiliarus, arterioles);
didina kapiliarų pralaidumą;
sutraukia žarnyno ir bronchų lygiuosius raumenis (gali sukelti astmos priepuolį);
skatina skrandžio sulčių sekreciją, reguliuoja imunines ląsteles.
Pakartotinio alergeno padirginimo metu išsiskyrę dideli histamino kiekiai gali sukelti histamininį šoką, kuris pasirešikai audinių paraudimu ir silpnumu.
Iš glutamo r. (Glu) susidaro γ-aminosviesto r. Daugiasiai jos susidaro galvos smegenų žievės pilkosios medžiagos sinapsėse, kur ji saugoma pūslelėse. γ-aminosviesto r. slopina nervinius impulsus padidindama pralaidumą Cl- ir K+ jonams. Kai trūksta γ-aminosviesto r., sukeliami traukuliai, todėl ji yra naudojama epilepsijos gydymui.
Iš tirozino (Tyr) susidaro tiraminas. Jis sutraukia lygiuosius raumenis, veikia didindamas kraujospūdį.
Iš serino (Ser) susidaro etanolaminas, kuris reikalingas fosfolipidų sintezei. Be to, iš jo susidaro cholinas.
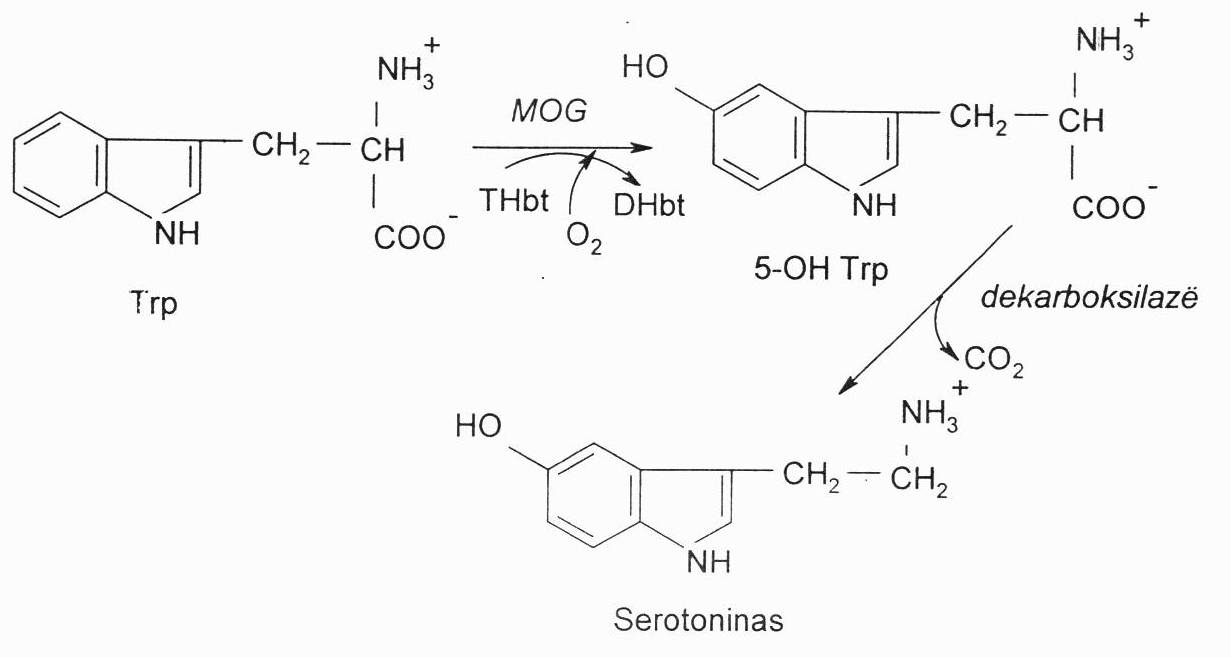
Iš triptofano (Trp) oksiduoto produkto (5-hidroksitriptofano) susidaro serotoninas. Jis susidaro galvos smegenų neuronuose, žarnyne, plaučiuose, trombocituose. Jis yra CNS neuromediatorius, sutraukia kraujagysles, didina kraujospūdį, svarbus termoreguliacijai. Padidėjęs jo kiekis arba didelės dozės sukelia paniką (turi įtakos nuotaikų kaitai), o per mažos dozės sukelia depresiją, todėl jis naudojamas kaip antidepresantas.
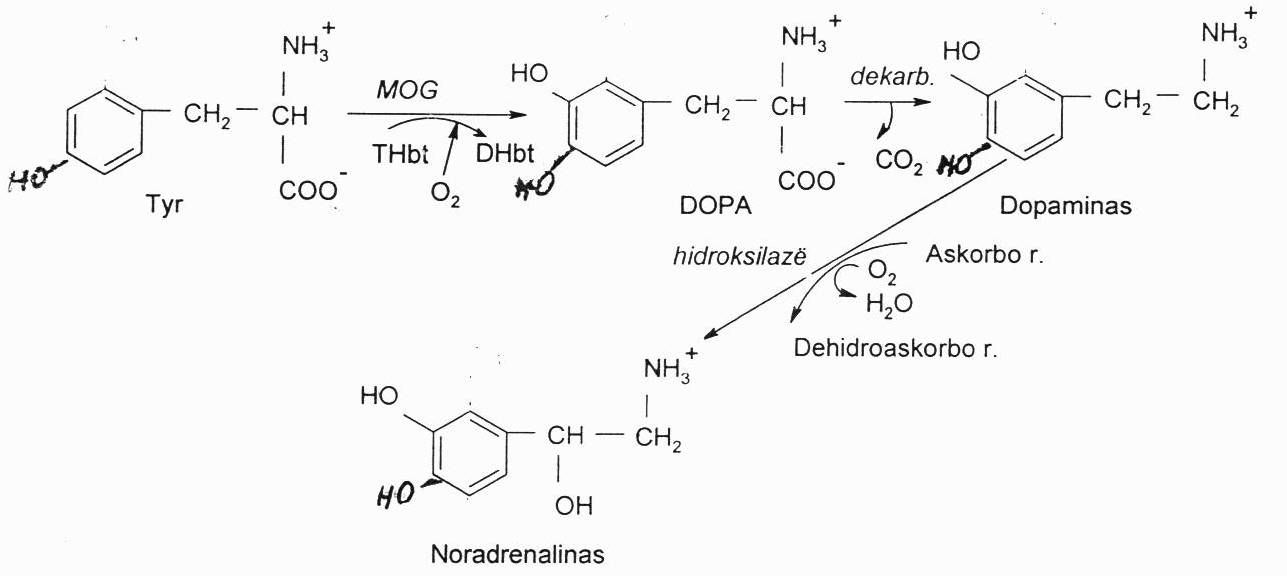
Iš Tyr oksiduoto produkto dihidroksifenilalanino (DOPA), jį dekarboksilinant, susidaro neuromediatorius dopaminas. Šį oksiduojant gaunamas noradrenalinas. Jį toliau metilinant galima gauti adrenaliną. R-jos produktas priklauso nuo ląstelės turimų fermentų. Dopaminas gaminamas ekstrapiramidinėje smegenų sistemoje, kuri atsakinga už koordinuotus judesius. Jos neuronai turi tik 2 aktyvius šios sintezės fermentus – hidroksilazę ir dekarboksilazę. Susidaręs dopaminas irgi saugomas su membrana asocijuotose pūslelėse, iš kur išskiriamas egzocitozės būdu. Trūkstant dopamino, vystosi Parkinsono liga, kuri gydoma vit. B6 dozėmis.
Biogeniniai aminai (katecholaminai):
Daugelis biogeninių aminų, pasižymi gana dideliu aktyvumu, dideli jų kiekiai organizmui yra toksiški, todėl jie nukenksminami kaip ir žarnyne monoaminoksidazių (MAO) ir diaminoksidazių (DAO) pagalba. Tai yra oksidacinio deamininimo būdas, susidaro amoniakas ir vandenilio peroksidas. Ir MAO, ir DAO randami daugelyje audinių, tarp jų ir neuronų mitochondrijose.

Susidarantys galutiniai nukenksminimo (skilimo) produktai:
iš histamino – metilimidazolo acetatas;
iš γ-aminosviesto r. – sukcinatas;
iš serotonino – 5-hidroksiindolacto r.;
iš dopamino – homovanilinė r.
Tokiu būdu jie yra nukenksminami ir šalinami iš organizmo (arba panaudojami).
B6 vitaminas:
Funkcijos
Vitaminas B6 dalyvauja baltymų ir aminorūgščių apykaitoje, taip pat dalyvauja ir riebalų apykaitoje, insulino gamyboje, raudonųjų ir baltųjų kraujo ląstelių formavimesi, fermentų ir kitų organizmo junginių sintezėje, reguliuoja ląstelių dauginimąsi bei diferenciaciją, stiprina imuninę sistemą.
Poreikis
Rekomenduojama vitamino B6 paros dozė vyrams yra 2 mg, moterims – 1,8 mg per dieną, nėščioms moterims 1,9 mg, maitinančioms – 2,5 mg vitamino B6.
Piridoksinas su folio rūgštimi yra svarbiausi vitaminai nėštumo metu.
Pagrindiniai šaltiniai
Piridoksino yra daugelyje produktų, nedideliais kiekiais – daržovėse, žuvies, mėsos ir pieno produktuose, mielėse, miltuose, kepenyse.
Natūralūs vitamino B6 šaltiniai – kviečių gemalai, rupi duona, špinatai, žaliosios pupelės, bananai, alaus mielės, morkos, vištiena, kiaušiniai, saulėgrąžos. Didelė dalis vitamino B6 suyra maistą verdant ar kepant, veikiant ultravioletiniams spinduliams.
Trūkumo simptomai
Piridoksino trūksta retai, dėl stokos gali pakisti oda, atsirasti odos, gleivinės ir liežuvio uždegimai, įtrūksta lūpų kampučiai, nuovargis, prislėgtumas, susilpnėti imunitetas. Kai yra didelis trūkumas, sutrikdomos kepenų ir nervų sistemos funkcijos, kalcio, magnio ir fosforo panaudojimas.
Pertekliaus simptomai
Perdozavimas galimas ilgai vartojant ypač didelės dozes – sutrinka nervų sistemos veiklą, sumažėja plaštakų ir pėdų taip pat liežuvio jautrumas. Jaučiamas nuovargis.
Savybės
Piridoksinas tirpsta vandenyje, kepenyse paverčiamas piridoksal-5–fosfat
Deamininus a.r., lieka anglies karkasas. Jis įvairiais specifiniais keliais įsijungia į Krebso ciklą. Glikogeninės a.r. – tokios a.r., kurių anglies karkasas į Krebso ciklą įsijungia per piruvatą, α-oksoglutaratą, sukcinil-KoA, fumaratą ir oksalacetatą. Ketogeninės a.r. – tokios a.r., kurių anglies karkasas įsijungia į acetotacetatą, acetilKoA ir acetoacetilKoA.
Grynai ketogeninės a.r.:
Leu;
Lys.
Mišrios (ir ketogeninės, ir glikogeninės) a.r.:
Ile;
Tre;
Trp;
Phe;
Tyr.

A.r. skilimas (katabolizmas) tarnauja trims tikslams:
energijos tiekimui per Krebso ciklą (papildo Krebso ciklą metabolitais);
tarpinių produktų kitoms sintezėms tiekimas (gliukozės, ketoninių medž.);
a.r. pertekliaus šalinimas.
42.
Kreatinfosfatas:
Kreatinfosfatas priklauso fosfagenams, makroerginiams junginiams, kuriuose makroerginis ryšys N∼P kreatinfosfato molekulėje, kuri yra 4 kartus mažesnė už ATP, sukaupta energija panaudojama būtent per substratinį fosforilinimą gaminant ATP. Daugiausia kreatinfosfato yra skersaruožiuose raumenyse. Jis pagrinde naudojamas raumenų darbui. Didžioji dalis yra panaudojama ATP sintezei, 1-2% ciklizuojasi į kreatininą, kuris šalinamas su šlapimu.
Kreatininas:
Kreatininas susidaro iš raumenyse kaupiamo makroerginio junginio – kreatinfosfato. Kreatininas yra kreatinfosfato spontaninio defosforilinimo bei iš jo raumenyse susidariusio kreatino dehidratacijos produktas.
Kreatinino susidarymas:
Ramybės būsenoje (kai ATP/ADP santykis yra didelis) raumenyse yra daug kreatinfosfato. Kai ATP/ADP santykis pasidaro mažas (raumenims susitraukinėjant), kreatinfosfatas naudojamas ATP atnaujinti – tai vyksta dėl grįžtamos kreatinkinazės (KK) r-jos. Tai vyksta pirmosiomis raumenų susitraukimo sekundėmis. Išsekus kreatinfosfatui, raumenys naudoja ATP gaunamą energiją iš glikolizės ar oksidacinės apykaitos.

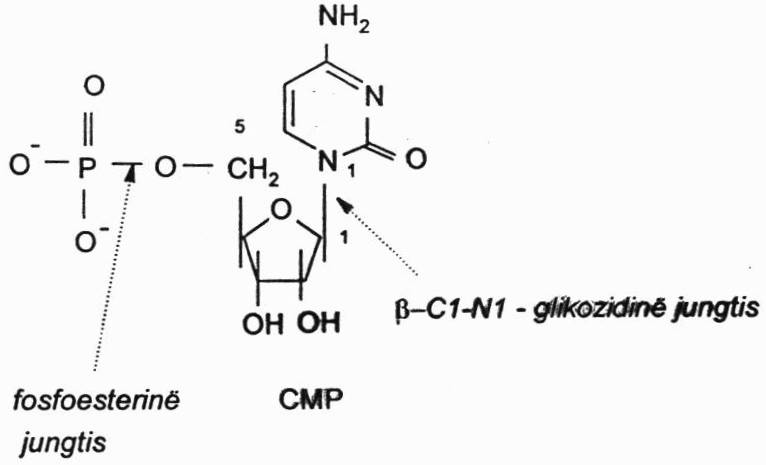
Mononukleotidai yra nukleorūgščių sintezės substratai. Tai kartu yra nukleorgūščių sudedamoji dalis. Patys mononukleotidai yra sudaryti iš 3 dalių: heterociklinės bazės, angliavandenių ribozės arba deoksiribozės ir iš fosforo rūgšties liekanų.
Heterociklinės azotinės bazės
Heterociklinės azotinės bazės, esančios nukleotidų sudėtyje yra purino ir pirimidino dariniai.
Purino bazės struktūra:
Purinas yra sudarytas iš pirimidino ir imidazolo žiedų, turinčių tam tikrą numeraciją, einančią prieš laikrodžio rodyklę. Svarbiausios purinų bazės, esančios nukleotiduose, iš kurių sintetinamos nukleorūgštys – adeninas ir guaninas yra adeninas – 6-aminopurinas, guaninas – 2-amino-6-oksopurinas. Hipoksantinas, ksanitinas ir šlapimo r. yra tarpiniai arba galutiniai purinų nukleotidų apykaitos produktai.

Pirimidino bazių struktūra:
Pirimidinų bazių pagrindas – pirimidino žiedas jau su kitokia numeracija – ji eina pagal laikrodžio rodyklę. Svarbiausios pirimidino bazės – citozinas, uracilas ir timinas. Atitinkamai rašant formulę pasiskirsto dvigubieji ryšiai.

Heterociklinės azotinės bazės turi amino grupes ir okso grupes, prijungtas prie žiedų, dėl to jų molekulių viduje labai lengvai vyksta oksidacija arba redukcija. Bazių hidroksidariniai gali būti laktaminės formos, kai yra prijungta okso grupė, arba gali būti laktiminės formos, kai būna OH grupė – hidroksilo. Amino dariniai būna arba amininė forma – NH2 grupė prijungta, arba gali būti imininė forma – NH grupė per dvigubąjį ryšį prijungta. Dažniausiai šios bazės būna laktaminės amininės formos (okso grupė ir amino grupė).
Nukleozidai:
Heterociklinių azotinių bazių junginiai su šiais angliavandeniais yra nukleozidai.
Purino nukleozidai – adenozinas ir guanozinas (bazės – adeninas ir guaninas). Juose susidaro β-C1-N9 glikozidinis ryšys tarp angliavandenio C1 atomo ir azotinės bazės N9 atomo.

Pirimidino nukleoziduose (citidinas, timidinas, uridinas) susidaro β-C1-N1 glikozidinis ryšys.
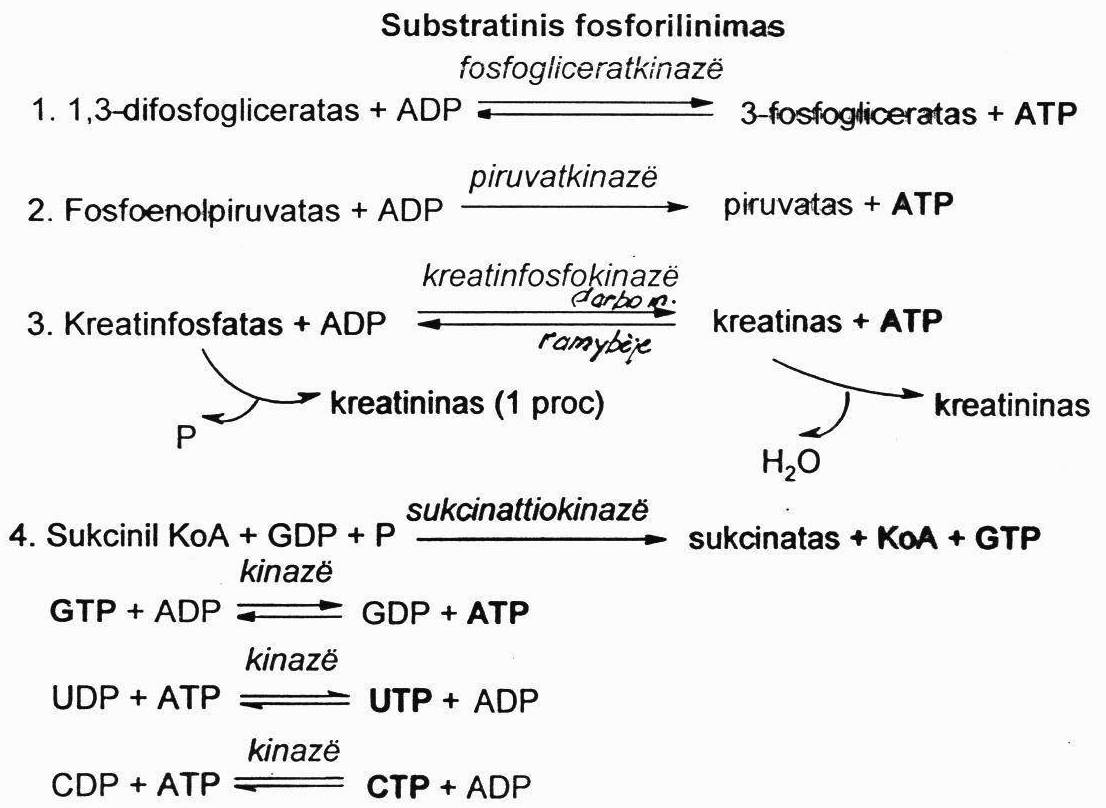
Cikliniai nukleotidai:
Tai – nukleotidai, kurių fosforo rūgštis prisijungusi dviem esteriniais ryšiais prie
pentozės 3ꞌ ir 5ꞌ-hidroksilgrupių. Svarbiausi yra du cikliniai nukleotidai: 3ꞌ ir 5ꞌ-adenozinmonofosfatas (cAMP) ir 3ꞌ ir 5ꞌ-guanozinmonofosfatas (cGMP). Jie yra viduląstelinių signalų tarpininkai.
Nukleotidų struktūros:
DNR struktūros:
DNR tai yra polinukleotidai, sudaryti iš keturių rūšių mononukleotidų – dAMP, dGMP, dCMP, TMP, sujungtų 5-3 arba 3-5 fosfodiesteriniais ryšiais. Šie ryšiai susidaro tarp 1 mononukleotido OH grupės esančios prie deoksiribozės 3 C atomo ir kito nukleotido fosforo r. liekanos, esančios prie deoksiribozės 5 C atomo. Polinukleotido pradžioje paprastai būna laisva fosfato grupė, o prie deoksiribozės 3 C atomo būna laisva OH grupė. Toks DNR karkasas yra įvardijamas kaip pirminė DNR struktūra.

Patį karkasą sudaro besikaitaliojantys deoksiribozė ir fosfatai, o šonines grupes taisyklingais intervalais prijungtos azotinės bazės. Fosfato grupė turi neigiamą krūvį netgi prie pH 7, o deoksiribozės OH grupės sudaro vandenilinius ryšius su vandeniu.
RNR struktūros:
Pagal struktūrą RNR yra linijiniai polinukleotidai, kuriuos sudaro mononukleotidai AMP, GMP, CMP ir UMP, sujungti 3-5 arba 5-3 fosfodiesteriniais ryšiais. Ribonukleorūgščių kovalentinis karkasas – pirminė struktūra – yra visiškai analogiška DNR pirminei struktūrai su dviem skirtumais:
vietoj TMP yra UMP;
vietoj deoksiribozės čia yra ribozė.
Eukariotų RNR sudaro viena polinukleotidinė grandinė. Virusai gali turėti ir dvigrandžių RNR.
Nukleosomos: Nukleosoma būna sudaryta iš 4 porų histonų: 2 histonai H2A, 2 – H2B, 2 – H3 ir 2 – H4 (susidaro oktameras). Jis 1,75 karto yra apsuktas DNR grandine – iš maždaug 146 bazių porų. Tai vadinamoji nukleosomos šerdis. Dar maždaug 60 bazių porų ilgio vadinamoji linkerinė DNR dalis (jungtukas) jungia vieną nukleosomos šerdį su kita, sudarydama lyg karoliukų vėrinį – polinukleosomą. Prie linkerinės dalies prisijungus histonui H1, DNR grandinė nukleosomą apsupa jau 2 kartus (pilnai) – tai yra 166 bazių poros. Tai sutrumpina DNR grandinę maždaug 7 kartus. RNR tipai:
Informacinės RNR yra sintetinamos nuo DNR, nurašant vieną koduojamą grandinę. Jos perduoda DNR informaciją apie polipeptidinės grandinės a.r. seką į ribosomas (jose vyksta baltymų sintezė). Prokariotų iRNR yra policistroninė – ji yra kelių polipeptidinių grandinių matrica. Eukariotų iRNR visada yra monocistroninė – nuo jos nurašoma tik viena polipeptidinė grandinė.
Eukariotuose paprastai nuo DNR nurašoma heterogeninė branduolio RNR – tai pirminis transkriptas, kuris vėliau subręsta. Pirminio transkripto modifikacijos yra vadinamos brendimu. Prokariotų informacinės RNR nebręsta.
Antrinė ir tretinė informacinių RNR struktūros yra savitos, jos yra reikalingos, kad informacinė RNR galėtų pereiti pro branduolio poras. Jų gyvavimo pusperiodis yra trumpas – nuo kelių minučių prokariotuose iki valandos eukariotuose. Jų dydis yra 6-25 svedbergų (E.coli). Svedbergas – sedimentacijos konstanta, nusakanti molekulės sedimentacijos greitį ultracentrifugoje, ji susijusi su molekulės forma ir mase.
Pernašos RNR yra mažos molio masės RNR (svedbergai, 4S). Jos perneša a.r. į ribosomas ir verčia nukleotidų kalbą į a.r. kalbą. Jų pirminėse struktūrose yra gana daug (maždaug 25%) neįprastų minorinių bazių – pseudoouracilo, dihidrouracilo ar hipoksantino. Tai rodo, kad po sintezės bręsta ir prokariotų ir eukariotų tRNR.
Geriausiai ištirta tRNR antrinė struktūra, primenanti dobilo lapą. tRNR turi akceptorinį kanalą, kurio 5’ gale visada yra GMP, o 3’ gale visada yra CCA tripletas. Toliau eina D kilpa, ji yra taip pavadinta, nes tarp jos nekomplentarių bazių yra 2 dihidrouracilai. Toliau eina psi kilpa, tarp kurios nekomplentarių bazių yra pseudouracilas. Dar toliau yra antikodoninis kamienas su antikodonine kilpa, kurioje yra tripletas (3 nukleotidai) antikodonas. Antikodonas paprastai vandeniliniais ryšiais jungiasi su jam komplementariu iRNR tripletu, vadinamu kodonu ir tokiu būdu transportinės RNR atnešta a.r. atranda savo vietą ribosomoje. Dar yra maža kintanti kilpelė – V kilpa.
Erdvėje dobilo lapo D ir psi kilpos sąveikauja vandeniliniais ryšiais, akceptorinis ir antikodoninis kanalai išsikiša stačiu kampu, molekulė įgauna apverstos L raidės formą – tai yra tretinė transportinių RNR struktūra.
Ribosominės RNR yra randamos ribosomų sudėtyje. Laisvų ribosominių RNR nebūna. Prokariotų ląstelėse yra trijų rūšių ribosominės RNR – 5S, 16S ir 23S, o eukariotų ląstelėse būna 5S, 5,8S, 18S ir 28S. Tos ribosominės RNR yra skirtingos molinės masės. Po sintezės bręsta ir prokariotų ir eukariotų rRNR. Ribosominės RNR pasižymi labai dideliu bazių komplementarumu ir yra labai susilankstę, sudarydamos spiralinius segmentus, atskirtus nespiralizuotų kilpų. Tokią jų antrinę struktūrą palaiko vandeniliniai ryšiai tarp bazių porų.
rRNR sąveikauja su ribosomų baltymais, sudarydamas ribonukleoproteinus – didįjį ir mažąjį ribosomų subvienetus. Tai yra tretinė ribosominių RNR struktūra. Manoma, kad baltymo funkcija yra suformuoti ir palaikyti tokią erdvinę ribosominių RNR struktūrą, kuri galėtų veikti kaip ribozimas ir katalizuotų peptidinio ryšio susidarymą.
Eukariotų ribosomos yra 80S dydžio, jų didysis subvienetas yra 60S, mažasis 40 S. Eukariotuose RNR ir baltymai santykiu yra 1:1. Didžiajame 60S subvienete yra 28S rRNR, 5,8S rRNR ir 5S rRNR ir maždaug 49 polipeptidinės grandinės. Mažajame 40S subvienete yra 18S rRNR ir maždaug 33 polipeptidinės grandinės.
Mažosios branduolio RNR, randamos tiktai eukariotuose, jų branduoliuose. Jos yra svarbios iRNR brendimui ir jos išnešimui į citozolį. Jos būna susijungę su savitaisiais baltymais į kompleksus, vadinamus mažosiomis ribonukleoproteinų dalelėmis. Smulkiau apie jas kol kas nėra tikslių duomenų. Ribosomos:
Baltymų sintezė vyksta ribonukleoproteininėse dalelėse – ribosomose. Ribosoma – tai kompleksas, sudarytas iš dviejų tarpusavyje surištų pagrindinių subvienetų. Šis kompleksas koordinuoja baltymų surinkimą.
Ląstelė gali turėti kelis milijonus ribosomų, kurių dydis 20-30 nanometrų. Ribosomos yra citoplazmos matrikse, taip pat ant endoplazminio tinklo membranų. Daugiausia ribosomų randama intensyviai besidauginančiose audinių ląstelėse. Paprastai ribosomos išsidėsto grupėmis – polisomomis. Polisomą sudaro nuo 7 iki 70 ribosomų. Manoma, kad ribosomos susidaro branduolėlyje, o paskui iš branduolio patenka į citoplazmą.
Ribosoma susideda iš dviejų nevienodų subdalelių (subvienetų), kurių kiekviena susidaro atskirai. Jos susijungia tik tada, kai iRNR prisijungia prie mažesniosios subdalelės. Ribosomoje iRNR slenka tarp subdalelių ir teikia informaciją baltymo biosintezei
Nukleorūgščių hidrolizė:
NR yra skaidomos virškinamajame trakte ir audiniuose.
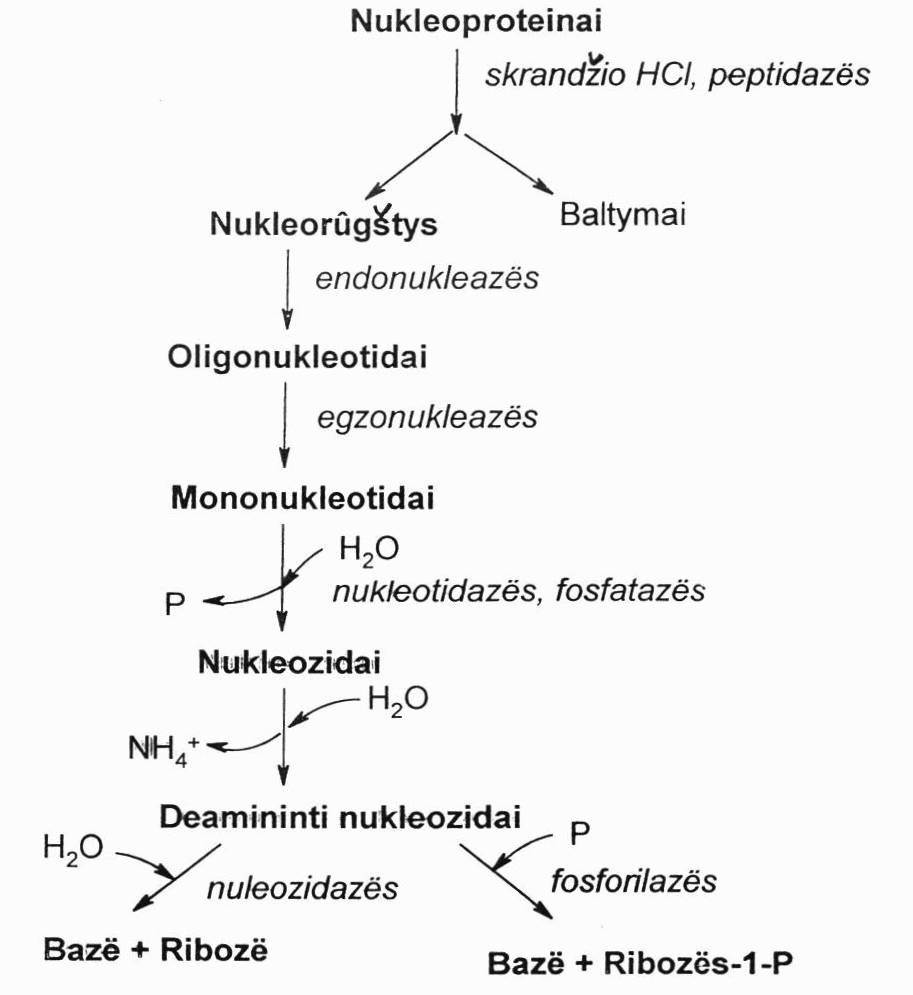
Maiste esančios nukleorūgšyts paprastai būna nukleoproteinų sudėtyje ir, veikiant skrandžio sulčių HCl, kuri denatūruoja baltymus, veikiant peptidazėms, pvz., pepsinui, NR yra atskeliamos nuo baltymų. Šis procesas vyksta virškinamajame trakte.
Endonukleazės ir egzonukleazės
Tai – nukleorūgščių polimerinės molekulės, kurios audiniuose daugiausiai skaidomos hidroliziniu būdu, katalizuojant specialiems fermentams nukleazėms.
Endonukleazės ardo vidinius tarpnukleotidinius DNR ir RNR molekulių ryšius. Įvyksta nukleorūgščių depolimerizacija ir susidaro oligonukleotidai.
Egzonukleazės katalizuoja galinių mononukleotidų hidrolizinį atskėlimą ir atskėlimą nuo DNR ir RNR bei oligonukleotidų molekulių galų
Purino nukleotidų skilimas:
Audiniuose purino mononukleotidai toliau yra hidrolizuojami audinių fermentų (gauti su maistu irgi skaidomi analogiškai, tiktai veikiant žarnyne esantiems tiems patiems fermentams). Rezorbuoti maisto nukleozidai yra skaidomi lygiai taip pat kaip ir audinių nukleotidai.
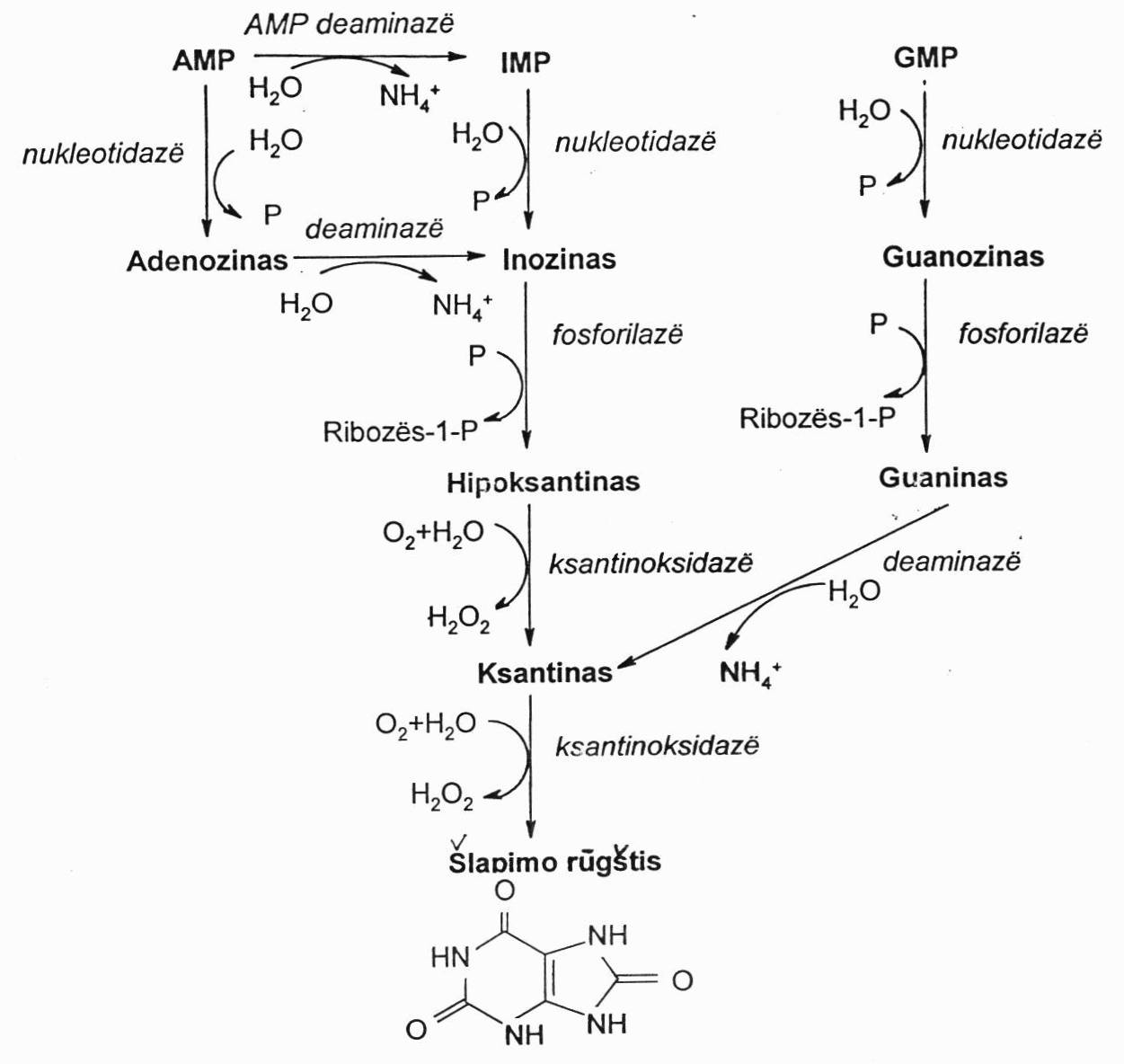
Svarbiausias skaidymo fermentas – ksantinoksidazė. Ji yra labai aktyvi kepenyse ir žarnų epitelyje. Kadangi tai yra oksidazė, tai ji perduoda elektronus deguoniui ir vienas iš šalutinių produktų yra vandenilio peroksidas. Galutinis skaidymo produktas – šlapimo r. Su šlapimu išskiriama maždaug 1g šlapimo r./parą. Jos normali konc. vyrų kraujo plazmoje 180-420 µmol/l, arba 0,18-0,42 mmol/l, moterų – 140-340 µmol/l arba 0,14-0,34mmol/l.
Šlapimo r. nėra toksiška medžiaga, bet ji yra mažai tirpi vandenyje ir, kai jos konc. padidėja, gali labai lengvai suformuoti kenksmingus kristalus inkstuose ir kituose audiniuose. Jie vadinami uratais. Šlapimo r. konc. kraujyje padidėjimas vadinamas hiperurikemija. Hiperurikemijos atveju kraujyje netgi prie normalaus kraujo pH, ji kristalizuojasi sudarydama su Na jonais druskas uratus. Ji ima kristalizuotis, kai jos konc. kraujyje viršija normą (0,4mmol/l).
Šlapime prie pH 5 šlapimo r. darosi irgi netirpi. Kai jos konc. pasiekia 0,9 mmol/l, inkstų surenkamuosiuose kanalėliuose susidaro akmenys. Maždaug 5-10% inkstų akmenų sudaro uratai
Pirimidino nukleotidų skilimas:
Pirimidino nukleotidai skyla panašiai į purino nukleotidus, bet skiriasi tuo, kad galutiniai skilimo produktai susidaro tirpūs, kurie nėra šalinami, o yra panaudojami organizme: susidaro amoniakas ir CO2. Jie nėra iš karto šalinami, bet pirmiau yra panaudojami šlapalo sintezei, o jau tada yra šalinami šlapalo pavidalu.
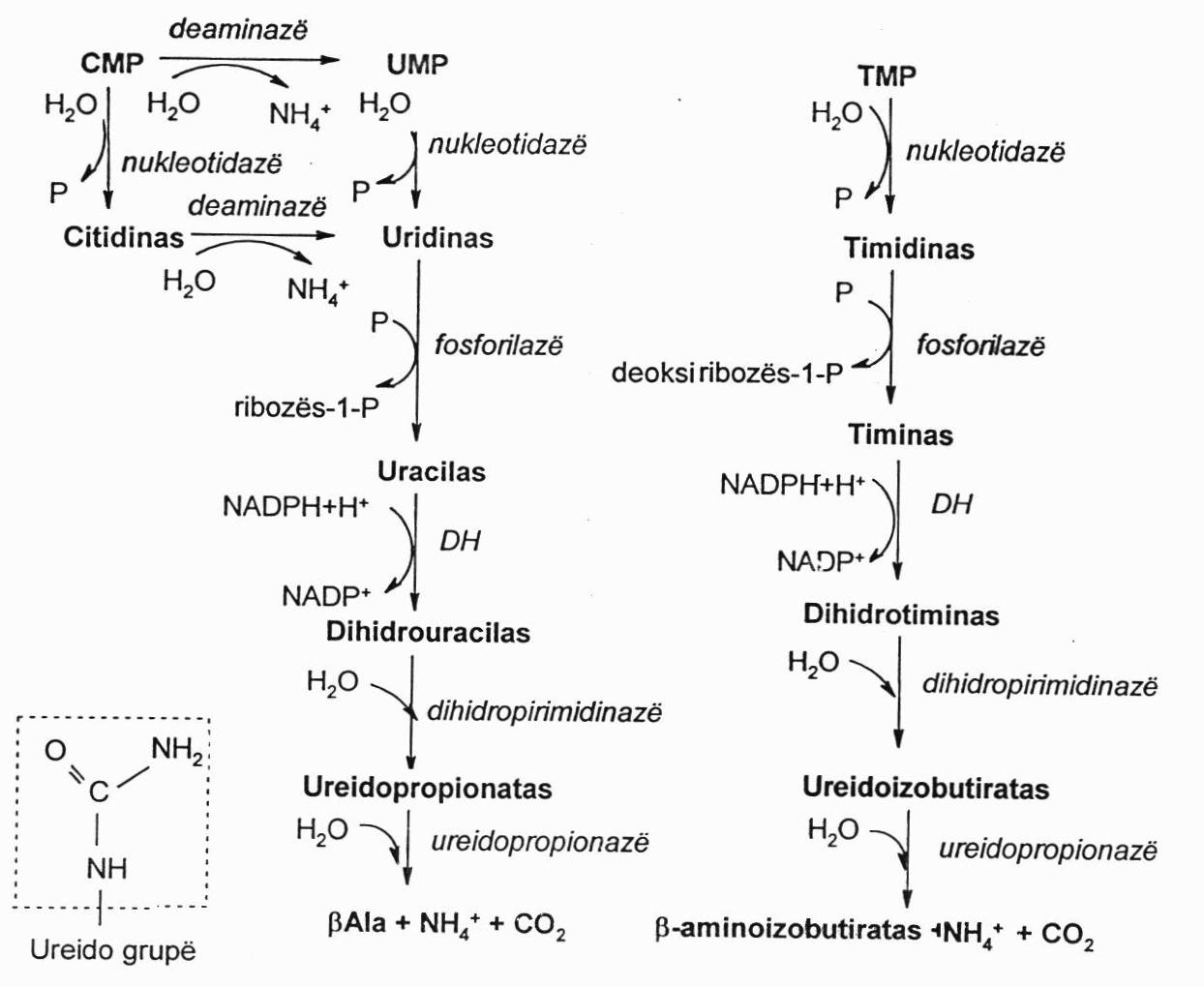
β-Ala gana daug būna kraujo plazmoje ir audinyje. Tai a.r., kurios baltymų sudėtyje nebūna. Žarnyne bakterijos ją įjungia į pantotenatą, kuris yra rezorbuojamas į kraują, patenka į audinius ir yra panaudojamas KoA sintezei. Raumenyse β-Ala yra naudojamas karnozino sintezei, o kai kurių gyvūnų raumenyse yra naudojamas anserino sintezei. β-Ala gali būti suskaidomas iki acetilKoA, kuris eina į Krebso ciklą.
Susidariusi β-aminoizosviesto r. (β-aminoizobutiratas) per propionilKoA ir metilmalonilKoA yra paverčiamas sukcinilKoA, kuris yra metabolizuojamas Krebso cikle. Sergančių onkologinėmis ligomis, po chemoterapijos, irsta ląstelės ir nemažai β-aminoizobutirato randama šlapime.
Podagra:
Esant hiperurikemijai netirpūs uratiniai mazgeliai susidaro poodyje (besimptominiai), o vėliau uratai ima kauptis sąnariuosiuose, sausgyslėse, inkstuose ir sukelia skausmą – susergama podagriniu artritu. Podagra – klinikinis terminas, nusakantis fiziologinį hiperurikemijos rezultatą. Podagra gali būti pirminė ir antrinė:
pirminė podagra gali būti:
maistinė, kurią sukelia gausiai vartojamas purino nukleotidų turtingas maistas – ikrai, balta mėsa, kava, arbata (kavoje daug kofeino, kuris yra purino bazė, arbatoje – teofilino). Hiperurikemija gali sukelti per dieną suvalgyti 4g mielių (šlapimo r. konc. kraujyje iš karto padidėja iki podagrinio lygio);
metabolinė, kai yra sutrikdoma purino nukleotidų sintezė. Pvz., padidėjus PRPP sintetazės aktyvumui ar amidotransferazės aktyvumui ir/arba gali būti suintensyvėjęs jų skaidymas. Skaidymas gali būti dėl perprodukcijos, arba dėl kitų priežasčių.
Įgimta – priežastis fermento hipoksantiguaninfosforiboziltransferazės dalinis nepakankamumas, nes tada nesuvartotas fosforibozilpirofosfatas aktyvina purinų sintezės de novo kelyje fermentą gliutaminamidotransferazę, kuri padidina purino nukleotidų sintezę maždaug 200 kartų.
antrinė podagra išsivysto dėl kitų ligų – pvz., dėl Girkės ligos, nes jos metu trūksta fermento gliukozės-6-fosfatazės. Tada gliukozės-6-P pentozių cikle yra verčiamas ribozės fosfatu, tada suintensyvėja purinų nukleotidų sintezė ir skaidymas. Taip pat gali būti inkstų nepakankamumo atvejų, kai mažai šlapimo r. šalinama su šlapimu ir didelė jos konc. lieka kraujyje.
Pirmiausia sergant podagra reikia žiūrėti maistą – reikia nevalgyti daug nukleotidų turinčio maisto. Pripažintas vaistas – alopurinolis. Jis yra hipoksantino struktūrinis analogas ir labai stipriai sujungia ksantino oksidazę ir tokiu būdu inhibuoja šlapimo r. susidarymą. Purino nukleotidai yra sintetinami 2 svarbesniais būdais :
sintezė iš naujo – sintezė de novo, kai naujai sintetinama purino bazė formuojama ant ribozės-5-P. Sintezės produktas visada būna ne laisva bazė, o nukleozidmonofosfatas – mononukleotidas.
naudojant jau susintetintas purino bazes – pakartotinis bazių panaudojimas, prijungiant jas prie aktyvaus ribozės-5-P.
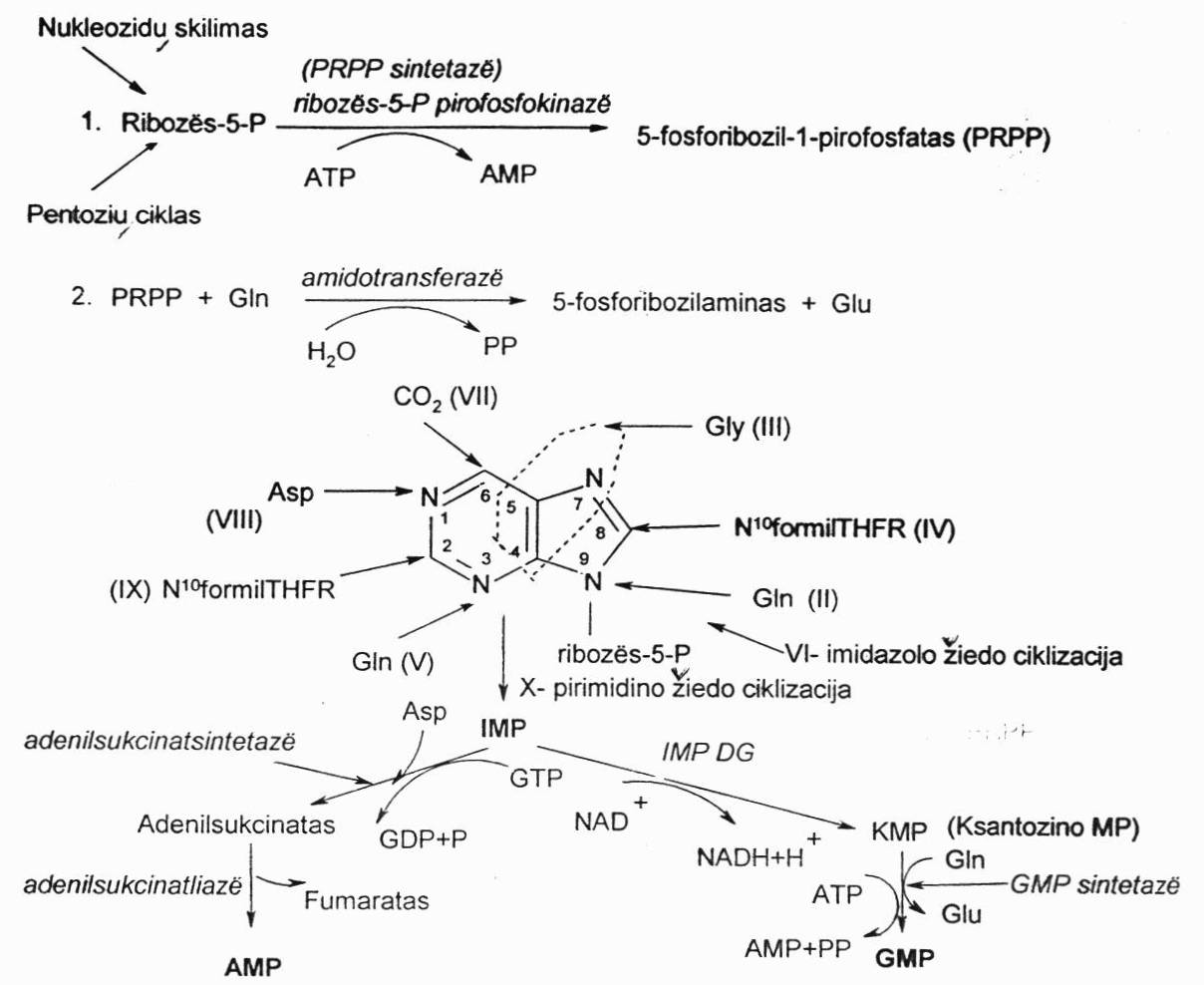
De novo kelias (purino sintezė)
I r-ja – sintetinant purino nukleotidus šiuo būdu reikalingas aktyvus ribozės-5-P, kuris gaunamas iš pentozių ciklo arba gali susidaryti skylant nukleozidams. Pirmiausia, kad prie jo būtų galima prijungti purino bazę, jis turi būti suaktyvintas. Jis suaktyvinamas katalizuojant PRPP sintetazei/kinazei. Šiuo atveju iš ATP paimama fosforo r. liekana ir susidaro 5-fosforibozilpirofosfatas – tai atyvi forma.
II r-ja prasideda purino bazės formavimasis. Tada, katalizuojant amidotransferazei, prie ribozės-5-P yra prijungiama amino grupė, paimta iš Gln – tai pradeda formuoti imidazolo žiedo 9 padėties azotą. Susidaro 5-fosforibozilaminas.
III r-ja – įjungiamas 4 ir 5 padėčių anglis ir 7 padėties azotas – iš Gly, jau turimas skeletas, formuojamas imidazolo žiedas.
IV r-ja – įvedama C į 8 padėtį iš N10-formilTHFR (gali būti ir iš metenilTHFR). Susiformuoja beveik imidazolo žiedas, tik jis neužsidaręs.
V r-ja – iš Gln įvedamas azotas į būsimąją 3 padėtį, turimas neužsidaręs karkasas.
VI r-ja – imidazolo žiedas ciklizuojasi.
VII r-ja – C iš CO2 į 6 padėtį.
VIII r-ja – N iš Asp į 1 padėtį.
IX r-ja – C iš N10-formilTHFR į 2 padėtį.
X r-ja – pirimidino žiedo ciklizacija.
Susidaręs purinas – inozinmonofosfatas (IMP) – ant ribozės-5-P susiformavo hipoksantino bazė. Tolimesnėse r-jose jis yra verčiamas AMP ir GMP:
Katalizuojant adenilatsukcinatsintetatasei susidaro adenilosukcinatas. Tam reikalingą energiją teikia GTP, tada atskyla fumaro r. ir susidaro AMP.
Katalizuojant IMP DG susidaro ksantino monofosfatas. Katalizuojtan GMP sintetazei iš Gln įvedama amino grupė ir susidaro GMP naudojant ATP energiją.
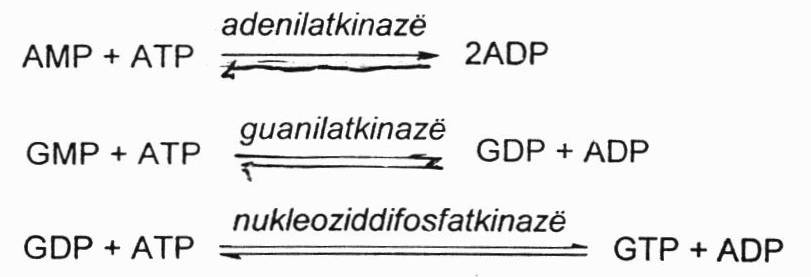
Trifosfatinės formos susidaro katalizuojant adenilatkinazei (kepenyse labai aktyvi) iš AMP susidaro ADP. Katalizuojant guanilatkinazei iš GMP susidaro GDP, o veikiant nukleoziddifosfatkinazei susidaro trifosfatinė forma.
Purino sintezė de novo būdu yra reguliuojama alosteriškai grįžtamojo ryšio principu trijose vietose:
svarbiausias sintezės greitį apsprendžiantis fermentas yra 2 r-jos fermentas amidotransferazė. Ją alosteriškai slopina r-jos produktai IMP, AMP ir GMP. Ją aktyvina PRPP – fosforibozilpirofosfatas.
kita reguliuojama vieta yra 1 r-ją katalizuojantis fermentas PRPP sintetazė. Ją slopina visi adenino ir guanino nukleotidai (ne tik AMP ir GMP, bet ir ADP, GDP ir ATP ir GTP). Aktyvina jį neorganinis fosfatas.
3 reguliuojama vieta – šakojimasis nuo IMP. Reikia atsiminti, kad susidaręs AMP slopina adenilosukcinatsintetazės aktyvumą, o GMP – inozinmonofosfatdehidrogenazės aktyvumą. Šitoks kontrolės mechanizmas palaiko abiejų nukleotidų AMP ir GMP balansą, nes ATP reikalingas GMP sintezei, o GTP reikalingas AMP sintezei. Tai reciprokinio reguliavimo pavyzdys.
Sintezė de novo būdu labai intensyvi kepenyse, bet nevyksta žmogaus eritrocituose, leukocituose, smegenyse, nes ten labai mažas amidotransferazės aktyvumas (smegenyse), o kraujo ląstelėse turbūt iš viso nėra. Todėl ten purino nukleotidai sintetinami naudojant laisvas purino bazes, susidariusias nukleotidų apykaitos metu (pvz., skylant NR). Tai vadinamasis pakartotinis bazių naudojimas arba alternatyvus kelias.
Pakartotinis bazių naudojimas
Pakartotinai naudojamas adeninas, hipoksantinas ir guaninas. Jie labai paprastai katalizuojant atitinkamoms transferazėms sujungiamos su PRPP ir susidaro AMP, IMP ir GMP. Šakojimasis toliau toks pats, atitinkamai naudojant Asp ar Gln, energijai naudojant ATP ar GTP.
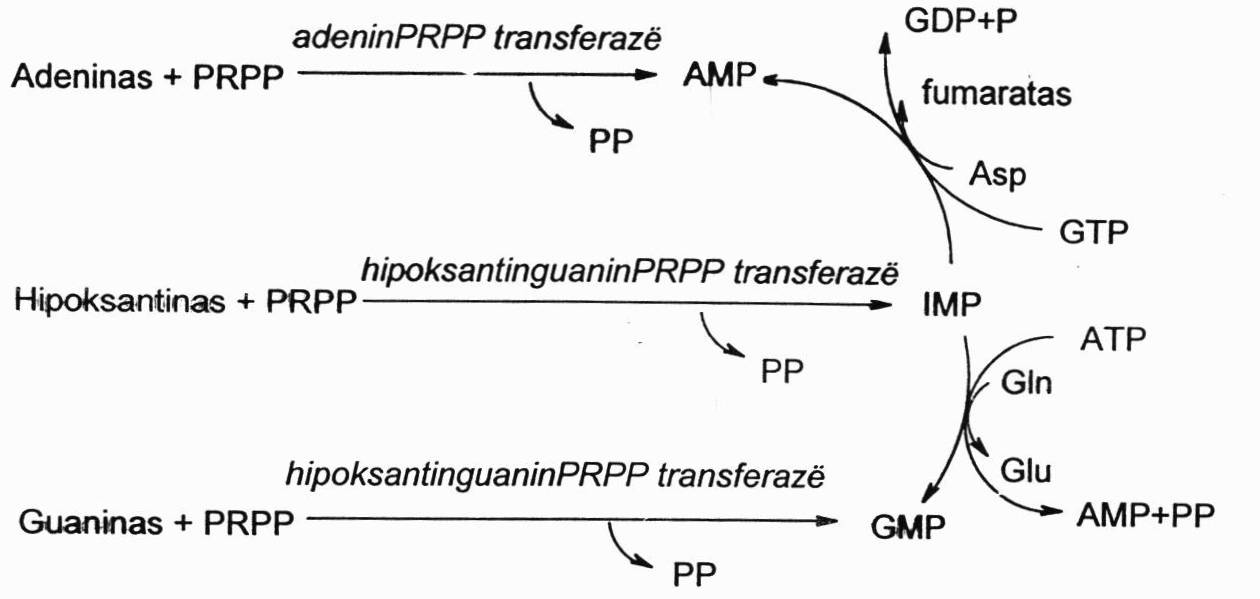
Įdomu tai, kad pirmoje r-joje dalyvauja fermentas adeninPRPPtransferazei, o kitoje r-joje – hipoksantinguaninPRPPtransferazė. Ji katalizuoja ir hipoksantino ir guanino r-jas. Šitas fermentas ypatingas tuo, kad galimas genetinis jo trūkumas, kurį turi išimtinai berniukai, nes už šio fermento sintezę atsakingas genas yra X chromosomoje. Moterys yra patologinio geno nešiotojos. Šis genetinis trūkumas pasireiškia eile simptomų, kurie yra įvardijami kaip Lešo-Najeno sindromas. Apie antruosius gyvenimo metus sutrinka berniukų koordinacija, vystosi protinis atsilikimas, vaikai tampa agresyvūs, gali net kandžiotis, gali save lengvai sužaloti, nes procesai smegenyse priklauso būtent nuo šito kelio.
Jeigo šitas fermentas yra, bet jo yra mažai, arba jis nepakankamai aktyvus, tai yra ir podagros priežastis, nes nesunaudojamas PRPP, jis padidina purinų sintezę de novo keliu maždaug 200 kartų. Padidėja purino nukleotidų sintezė – suintensyvėja ir skilimas, skyla iki šlapimo r. – vystosi hiperurikemija, kuri veda į podagrą. Prie to prisideda ir laisvos bazės, kurios skaidomos iki šlapimo r., kurios daug būna kraujyje.